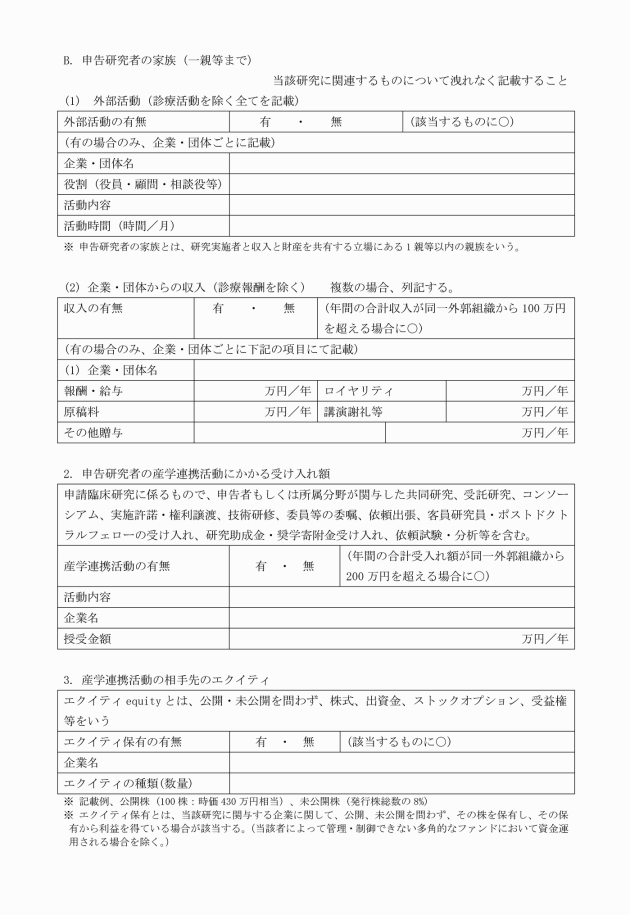
○山陽小野田市立山口東京理科大学における人を対象とする生命科学・医学系研究に関する規程
平成30年10月1日
規程第92号
目次
第1章 総則(第1条・第2条)
第2章 研究者等の責務(第3条―第5条)
第3章 研究計画書(第6条―第8条の2)
第4章 倫理審査委員会(第9条―第22条)
第5章 インフォームド・コンセント等(第23条―第26条)
第6章 個人情報等(第27条―第29条)
第7章 重篤な有害事象への対応(第30条)
第8章 研究の信頼性確保(第31条・第32条)
第9章 その他(第33条―第35条)
附則
第1章 総則
(目的)
第1条 この規程は、ヘルシンキ宣言(1964年6月世界医師会)及びヒトゲノム研究に関する基本原則(平成12年6月14日科学技術会議生命倫理委員会)に示された基本原則の理念並びに人を対象とする生命科学・医学系研究に関する倫理指針(令和3年3月23日文部科学省・厚生労働省・経済産業省。以下「生命・医学系倫理指針」という。)に基づき、山陽小野田市立山口東京理科大学(以下「本学」という。)における人を対象とする生命科学・医学系研究に携わる全ての関係者が遵守すべき事項を定めることにより、人間の尊厳及び人権を守り、研究の適正な推進を図ることを目的とする。
① 傷病の成因(健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を含む。)の理解、病態の理解、傷病の予防方法の改善又は有効性の検証、医療における診断方法及び治療方法の改善又は有効性の検証を通じて、国民の健康の保持増進又は患者の傷病からの回復若しくは生活の質の向上に資する知識を得ること。
② 人由来の試料・情報を用いて、ヒトゲノム及び遺伝子の構造又は機能並びに遺伝子の変異又は発現に関する知識を得ること。
(2) 侵襲 研究目的で行われる、穿刺、切開、薬物投与、放射線照射、心的外傷に触れる質問等によって、研究対象者の身体又は精神に傷害又は負担が生じることをいう。侵襲のうち、研究対象者の身体及び精神に生じる傷害及び負担が小さいものを軽微な侵襲という。
(3) 介入 研究目的で、人の健康に関する様々な事象に影響を与える要因(健康の保持増進につながる行動及び医療における傷病の予防、診断又は治療のための投薬、検査等を含む。)の有無又は程度を制御する行為(通常の診療を超える医療行為であって、研究目的で実施するものを含む。)をいう。
(4) 人体から取得された試料 血液、体液、組織、細胞、排泄物及びこれらから抽出したDNA等、人の体の一部であって研究に用いられるもの(死者に係るものを含む。)をいう。
(5) 研究に用いられる情報 研究対象者の診断及び治療を通じて得られた傷病名、投薬内容、検査又は測定の結果等、人の健康に関する情報その他の情報であって研究に用いられるもの(死者に係るものを含む。)をいう。
(6) 研究対象者 次に掲げるいずれかに該当する者(死者を含む。)をいう。
① 研究を実施される者(研究を実施されることを求められた者を含む。)
② 研究に用いられることとなる既存資料・情報を取得された者
(7) 共同研究機関 研究計画書に基づいて研究を共同して実施する研究機関をいい、当該研究のために研究対象者から新たに試料・情報を取得し、他の研究機関に提供を行う機関を含む。
(8) 多機関共同研究 一の研究計画書に基づき複数の研究機関において実施される研究をいう。
(9) 研究者等 研究責任者その他の研究の実施に携わる関係者をいい、新たに試料・情報を取得し、研究機関に提供のみを行う者、研究機関以外において既存資料・情報の提供のみを行う者及び委託を受けて研究に関する業務の一部に従事する者を除く。
(10) 研究責任者 本学の専任教育で、研究に係る業務を統括する者をいう。
(11) 研究代表者 多機関共同研究を実施する場合に、複数の研究機関の研究責任者を代表する研究責任者をいう。
(12) インフォームド・コンセント 研究対象者等が、実施又は継続されようとする研究に関して、当該研究の目的及び意義並びに方法、研究対象者に生じる負担、予測される結果(リスク及び利益を含む。)等について研究者等又は既存試料・情報の提供のみを行う者から十分な説明を受け、それらを理解した上で自由意思に基づいて研究者等又は既存試料・情報の提供のみを行う者に対し与える、当該研究(試料・情報の取扱いを含む。)を実施又は継続されることに関する同意をいう。
(13) 代諾者 生存する研究対象者の意思及び利益を代弁できると考えられる者であって、当該研究対象者がインフォームド・コンセントを与える能力を欠くと客観的に判断される場合に、当該研究対象者の代わりに、研究者等又は既存試料・情報の提供のみを行う者に対して、インフォームド・コンセントを与えることが法律上ないし事実上できる者をいう。
(14) 代諾者等 代諾者に加えて、研究対象者が死者である場合にインフォームド・コンセントを与えることが法律上ないし事実上できる者を含めたものをいう。
(15) インフォームド・アセント インフォームド・コンセントを与える能力を欠くと客観的に判断される研究対象者が、実施又は継続されようとする研究に関して、その理解力に応じた分かりやすい言葉で説明を受け、当該研究を実施又は継続されることを理解し、賛意を表することをいう。
2 この規程において使用するその他の用語の定義については、生命・医学系倫理指針における用語の定義を適用する。
第2章 研究者等の責務
(研究者等の責務)
第3条 研究者等は、生命・医学系研究を実施するに当たっては生命・医学系倫理指針に規定された研究者等の責務を遵守しなければならない。
2 研究者等は、生命・医学系研究の実施に先立ち、研究に関する倫理並びに当該研究の実施に必要な知識及び技術に関する教育・研修を受けなければならない。また、研究期間中も1年に1回以上の教育・研修を受けなければならない。
(研究責任者の責務)
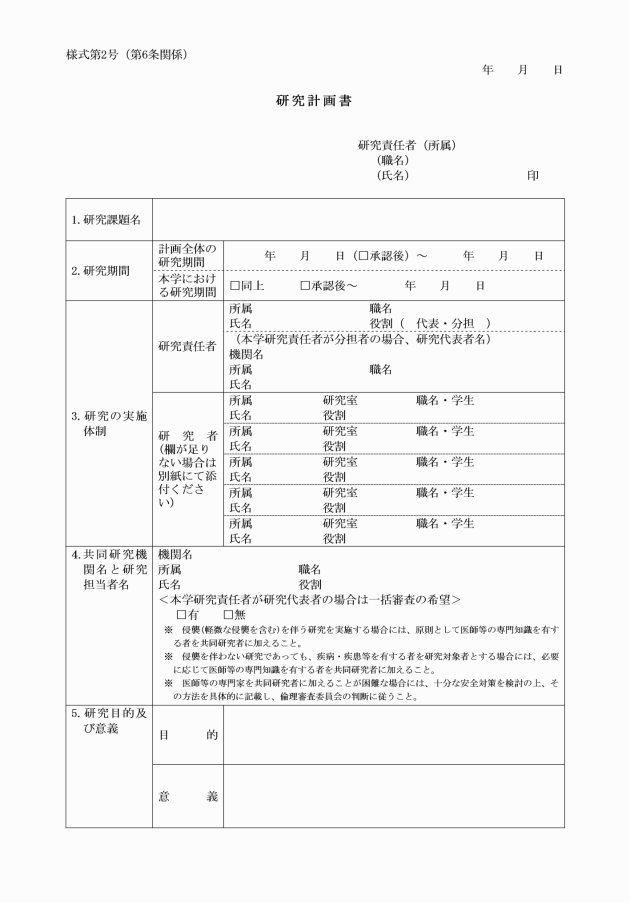
第4条 研究責任者は、生命・医学系研究の実施に先立ち、適切な研究計画書を作成しなければならない。研究計画書を変更するときも同様とする。
2 研究責任者は、研究の倫理的妥当性及び科学的合理性が確保されるよう、研究計画書を作成しなければならない。また、研究計画書の作成に当たって、研究対象者への負担並びに予測されるリスク及び利益を総合的に評価するとともに、負担及びリスクを最小化する対策を講じなければならない。
3 研究責任者は、侵襲(軽微な侵襲を除く。)を伴う研究であって通常の診療を超える医療行為を伴うものを実施しようとする場合には、当該研究に関連して研究対象者に生じた健康被害に対する補償を行うために、あらかじめ、保険への加入その他の必要な措置を適切に講じなければならない。
4 研究責任者は、第22条の規定により、研究の概要その他の研究に関する情報を適切に登録するとともに、研究の結果については、これを公表しなければならない。
5 研究責任者は、研究計画書に従って研究が適正に実施され、その結果の信頼性が確保されるよう、当該研究の実施に携わる研究者をはじめとする関係者を指導・管理しなければならない。
6 研究責任者は、生命・医学系研究の実施に当たっては、生命・医学系倫理指針に規定された研究責任者の責務を遵守しなければならない。
(学長の責務)
第5条 学長は、実施を許可した生命・医学系研究が適正に実施されるよう必要な監督を行うことについての責任を負うものとする。
2 学長は生命・医学系倫理指針に規定された研究機関の長としての責務を負う。
3 学長は、この規程に定めた事務を本学の適切な者に委任することができる。
第3章 研究計画書
(研究計画に関する申請)
第7条 研究責任者は、倫理審査委員会に意見を聴いた後に、その結果及び当該倫理審査委員会に提出した書類を学長に提出し、当該研究の実施について、許可を受けなければならない。
2 研究代表者は、原則として、多機関共同研究に係る研究計画書について、一の倫理審査委員会による一括した審査(以下「一括審査」という。)を求めなければならない。
(研究計画の許可)
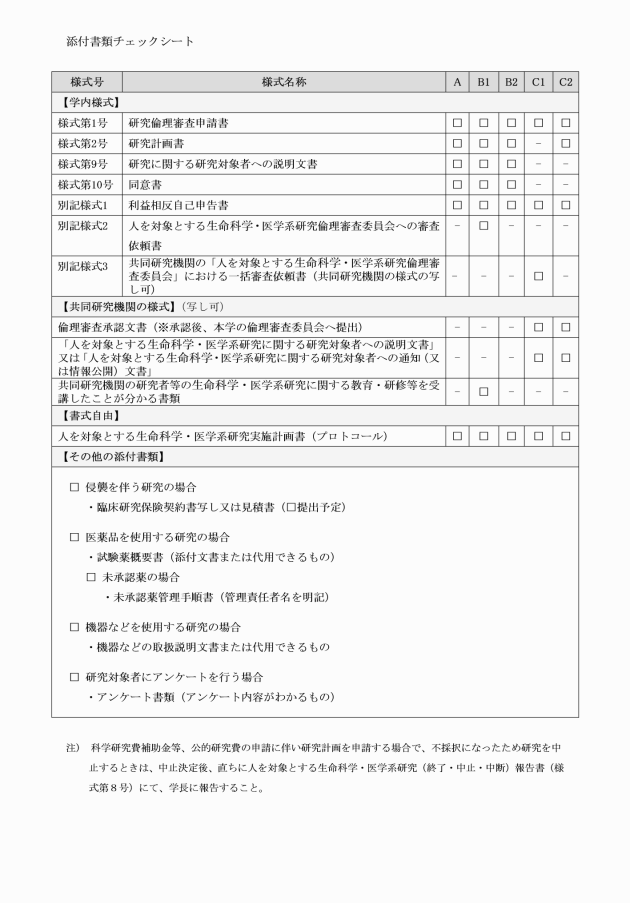
第8条 倫理審査委員会は、研究責任者から研究の実施の適否等について意見を求められたときは、倫理的観点及び科学的観点から、これを審査し、その結果を研究倫理審査結果報告書(様式第3号)により、研究責任者に答申するものとする。
2 学長は、研究責任者から生命・医学系研究の実施の許可を求められたときは、倫理審査委員会の意見を尊重しつつ、当該研究の実施の許可又は不許可その他研究について必要な措置について決定しなければならない。この場合において、学長は、倫理審査委員会が研究の実施について不適当である旨の意見を述べたときには、当該研究の実施を許可してはならない。
(倫理審査委員会による事前確認)
第8条の2 倫理審査委員会は、審査に先立ち、あらかじめ指名した委員により事前確認を行い、意見を述べることができる。
2 事前確認に関し必要な事項は、委員会が別に定める。
第4章 倫理審査委員会
(倫理審査委員会の設置)
第9条 学長は、生命・医学系倫理指針に基づき、研究の実施又は継続の適否その他研究に関し必要な事項について、倫理的及び科学的な観点から調査審議するため、倫理審査委員会を置く。
(倫理審査委員会の役割・責務等)
第10条 倫理審査委員会は、研究責任者から研究の実施の適否等について意見を求められたときは、生命・医学系倫理指針に基づき、倫理的観点及び科学的観点から、本学及び研究者等の利益相反に関する情報も含めて中立的かつ公正に審査を行い、文書又は電磁的方法により意見を述べなければならない。
2 倫理審査委員会は、前項の規定により審査を行った研究について、倫理的観点及び科学的観点から必要な調査を行い、研究責任者に対して、研究計画書の変更、研究の中止その他当該研究に関し必要な意見を述べるものとする。
3 倫理審査委員会は、第1項の規定により審査を行った生命・医学系研究のうち、侵襲(軽微な侵襲を除く。)を伴う研究であって介入を行うものについて、当該研究の実施の適正性及び研究結果の信頼性を確保するために必要な調査を行い、研究責任者に対して、研究計画書の変更、研究の中止その他当該研究に関し必要な意見を述べるものとする。
4 倫理審査委員会は、第1項の規定により審査を行った研究に関する審査資料を当該研究の終了について報告される日までの期間(侵襲(軽微な侵襲を除く。)を伴う研究であって介入を行うものに関する審査資料にあっては、当該研究の終了について報告された日から5年を経過した日までの期間)、適切に保管しなければならない。
5 学長は、倫理審査委員会の運営を開始するに当たって、倫理審査委員会の組織及び運営に関する規程並びに委員名簿を厚生労働省が設置する倫理審査委員会報告システム(以下「倫理審査委員会報告システム」という。)において公表しなければならない。また、学長は、年1回以上、倫理審査委員会の開催状況及び審査の概要について、倫理審査委員会報告システムにおいて公表しなければならない。ただし、審査の概要のうち、研究対象者等及びその関係者の人権又は研究者等及びその関係者の権利利益の保護のため非公開とすることが必要な内容として倫理審査委員会が判断したものについては、この限りでない。
6 倫理審査委員会の委員及びその事務に従事する者は、その業務上知り得た情報を正当な理由なく漏らしてはならない。その業務に従事しなくなった後も同様とする。
7 倫理審査委員会の委員及びその事務に従事する者は、第1項の規定により審査を行った研究に関連する情報の漏えい等、研究対象者等の人権を尊重する観点並びに当該研究の実施上の観点及び審査の中立性若しくは公正性の観点から重大な懸念が生じた場合には、速やかに学長に報告しなければならない。
8 倫理審査委員会の委員及びその事務に従事する者は、審査及び関連する業務に先立ち、倫理的観点及び科学的観点からの審査等に必要な知識を習得するための教育・研修を受けなければならない。また、その後も、適宜継続して教育・研修を受けなければならない。
(倫理審査委員会の構成及び会議の成立要件等)
第11条 倫理審査委員会は、次に掲げる者をもって組織する。
(1) 医学・医療の専門家等、自然科学の有識者 若干人
(2) 倫理学・法律学の専門家等、人文・社会科学の有識者 若干人
(3) 研究対象者の観点も含めて一般の立場から意見を述べることのできる者 若干人
(4) 必要に応じて学長が認めた者 若干人
2 倫理審査委員会の構成は、次の要件を全て満たすものとし、会議成立についても同様の要件とする。
(2) 本学に所属する専任教育職員及び本学に所属しない者がそれぞれ複数人含まれること。
(3) 男女両性で構成されていること。
(4) 5人以上の委員で構成されていること。
3 委員は、学長が委嘱する。
4 委員の任期は2年とし、再任を妨げない。ただし、補欠による後任者の任期は、前任者の残任期間とする。
5 委員の関与する研究計画等について審査を行うときは、当該委員はその審議及び議決に加わることはできない。ただし、倫理審査委員会の求めに応じ、会議に出席し、当該研究に関する説明を行うことはできる。
6 倫理審査委員会は研究計画等の審査に当たり、必要に応じ、当該研究の研究責任者又は研究者等を出席させ、当該研究の内容その他審査等に必要な事項について説明を求め、意見を聴くことができる。
7 審査を依頼した研究責任者は、倫理審査委員会の審議及び意見の決定に参加してはならない。ただし、倫理審査委員会における当該審査の内容を把握するために必要な場合には、倫理審査委員会の同意を得た上で、その会議に同席することができる。
8 倫理審査委員会は、審査の対象、内容等に応じて有識者に意見を求めることができる。
9 倫理審査委員会の意見は、全会一致をもって決定するよう努めなければならない。ただし、審議を尽くしても意見が取りまとまらない場合に限り、出席委員の3分の2以上の多数の意見をもって、倫理審査委員会の意見とすることができる。
(倫理審査委員会委員長)
第12条 倫理審査委員会に委員長(以下「委員長」という。)を置き、委員長は委員のうちから学長が指名する。
2 委員長が事故等で出席できないときは、委員長があらかじめ指名した委員がその職務を代理する。
3 委員長が研究者等となる場合は、委員長があらかじめ指名した委員がその職務を代理する。
4 倫理審査委員会は、委員長が招集し、その議長となる。
(判定の区分)
第13条 倫理審査委員会の審査の判定は、次に掲げる区分により行う。
(1) 承認
(2) 条件付承認
(3) 不承認
(4) 保留(継続審査)
(5) 停止(研究の継続には更なる説明が必要)
(6) 中止(研究の継続は適当ではない)
(書面等による審査)
第14条 委員長は、議案内容から合理的に判断し、書面による審査等が可能と認める場合には、書面又は電磁的記録(以下「書面等」という。)により、審査を行うことができる。
2 書面等による審査結果は、原則として倫理審査委員会委員全員の合意によるものとする。ただし、審議を尽くしても意見が取りまとまらない場合に限り、委員長は倫理審査委員会を招集し審査を行うことができる。
3 倫理審査委員会は、書面等による審査結果について、研究倫理審査結果報告書(様式第3号)により、研究責任者に対して意見を述べるものとする。
(迅速審査)
第15条 倫理審査委員会は、次に掲げるいずれかに該当する審査について、委員長及び委員長があらかじめ指名した委員複数人による審査(以下「迅速審査」という。)を行い、意見を述べることができる。
(1) 多機関共同研究であって、本学の研究責任者が分担者であり、本学が担当する研究内容を含む当該研究の全体について、既に共同研究機関における倫理審査委員会の審査を受け、その実施について適当である旨の意見を得ている場合の審査
(2) 研究計画書の軽微な変更に関する審査
(3) 侵襲を伴わない研究であって介入を行わないものに関する審査
(4) 軽微な侵襲を伴う研究であって介入を行わないものに関する審査
2 迅速審査の結果は倫理審査委員会の意見として取り扱うものとし、当該審査結果は研究倫理審査結果報告書(様式第3号)により、全ての倫理審査委員に報告しなければならない。
3 倫理審査委員会は、第1項第2号に該当する事案のうち、倫理審査委員会が事前に確認のみで良いと認めたものについて、あらかじめ具体的にその内容と運用等を定めることで、報告事項として取り扱うことができる。
(共同研究機関における一括審査)
第16条 研究責任者は、第7条第2項に基づき、多機関共同研究により実施する生命・医学系研究に係る研究計画書について、共同研究機関の倫理審査委員会における一括審査を希望する場合、共同研究機関へ提出する申請書類等を添えて、研究代表者に提出するものとする。
2 研究責任者は、共同研究機関の倫理審査委員会における審査結果を受けたときは、その結果を倫理審査委員会へ報告するものとする。
3 倫理審査委員会は、前項の報告を受けたときは、当該研究計画を確認し、当該研究の実施に当たっての助言を学長へ述べることができる。
4 学長は共同研究機関における倫理審査委員会の審査結果及び倫理審査委員会の助言を尊重し、当該研究計画の実施の許可又は不許可その他研究について必要な措置を決定しなければならない。この場合において、学長は、共同研究機関の倫理審査委員会より当該研究の実施について不適当である旨の審査結果を受けたときには、当該研究の実施を許可してはならない。
(本学における一括審査)
第17条 倫理審査委員会は、研究代表者から、共同研究機関と共同して実施する生命・医学系研究に係る研究計画書について、本学における一括審査の依頼を受けたときは、審査できるものとする。
2 倫理審査委員会は、意見を速やかに研究代表者に通知する。
(研究計画書からの逸脱)
第18条 研究責任者は、研究対象者の危険を回避するため又はその他医療上やむを得ない理由により研究計画書からの逸脱を行った場合には、当該研究責任者の所属する部局の長(以下「当該学部長等」という。)と学長の両方に対して、直ちに口頭で報告しなければならない。更に、その旨及び理由を記載した、緊急の危険を回避するための研究計画書からの逸脱に関する報告書(様式第5号)を、学長に提出するものとする。
2 学長は、前項に規定する報告を受けたときは、緊急の危険を回避するための研究計画書からの逸脱に関する報告書を倫理審査委員会に提出し、当該研究の継続の適否等について諮問するものとする。
3 学長は、倫理審査委員会の答申に基づき、当該研究の継続の適否等について決定し、研究倫理審査結果通知書(様式第4号)にて当該研究責任者に通知するものとする。
(研究計画の変更)
第19条 研究責任者は、生命・医学系研究の実施期間中に研究計画を追加、更新又は改定する場合は、研究計画変更申請書(様式第6号)を、倫理審査委員会に提出するものとする。
3 学長は、倫理審査委員会の答申に基づき、当該研究の変更の適否等について決定し、研究審査結果通知書にて当該研究責任者に通知するものとする。
(研究の状況報告及び継続の適否)
第20条 研究責任者は、生命・医学系研究を継続するに当たり、少なくとも年1回、実施中の生命・医学系研究の進捗状況及び有害事象、不具合等の発生状況について研究実施状況報告書(様式第7号)を、学長に提出しなければならない。
3 学長は、倫理審査委員会の答申に基づき、当該研究の継続の適否等について決定し、研究倫理審査結果通知書(様式第4号)にて当該研究責任者に通知するものとする。
(研究の終了、中止及び中断)
第21条 研究責任者は、生命・医学系研究が終了したときは、速やかに研究報告書(様式第8号)を、学長に提出するものとする。
2 研究責任者は、生命・医学系研究を中止又は中断したときは、その理由を当該研究対象者等に説明するとともに、速やかに研究報告書(様式第8号)を、学長に提出するものとする。
3 学長は前2項に規定する報告を受けたときは、速やかに倫理審査委員会に対しその旨を通知するものとする。
(研究の概要及び結果の登録・公表)
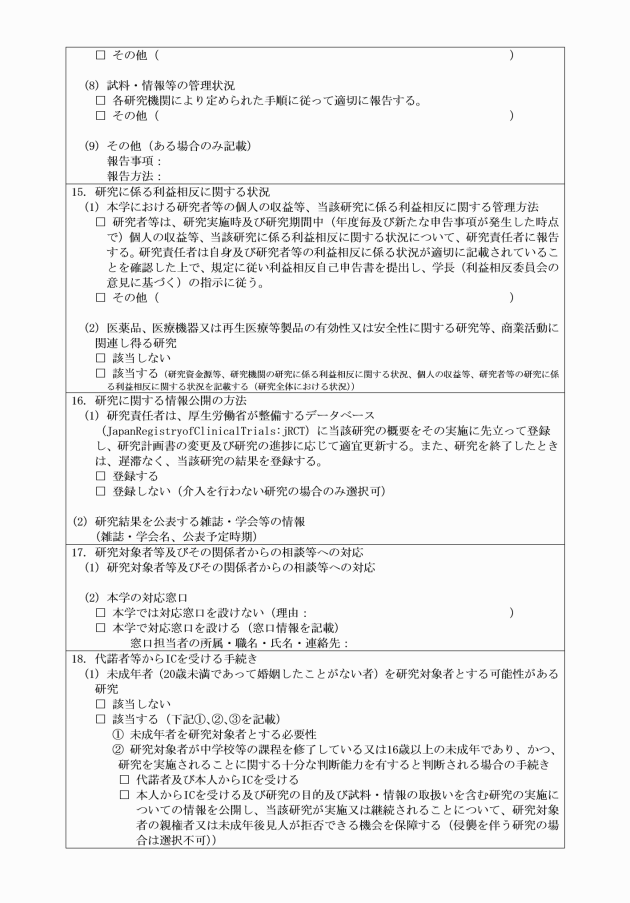
第22条 研究責任者は、介入を行う生命・医学系研究について、厚生労働省が整備するデータベース(JapanRegistryofClinicalTrials:jRCT)等に、当該研究の概要をその実施に先立って登録し、研究計画書の変更及び研究の進捗に応じて更新しなければならない。それ以外の研究についても当該研究の概要をその研究の実施に先立って登録し、研究計画書の変更及び研究の進捗に応じて更新するよう努めなければならない。また、研究を終了したときは、遅滞なく、当該研究の結果を登録しなければならない。ただし、研究対象者等及びその関係者の人権又は研究者等及びその関係者の権利利益の保護のため非公開とすることが必要な内容として、倫理審査委員会の意見を受けて学長が許可したものについては、この限りでない。
2 研究責任者は、生命・医学系研究を終了したときは、遅滞なく、研究対象者等及びその関係者の人権又は研究者等及びその関係者の権利利益の保護のために必要な措置を講じた上で、当該研究の結果を公表しなければならない。また、侵襲(軽微な侵襲を除く。)を伴う生命・医学系研究であって介入を行うものについて、結果の最終の公表を行ったときは、遅滞なく学長へ報告しなければならない。
第5章 インフォームド・コンセント等
(インフォームド・コンセント)
第23条 研究者等が研究を実施しようとするとき又は既存試料・情報の提供のみを行う者が既存試料・情報を提供しようとするときは、学長の許可を受けた研究計画書に定めるところにより、それぞれ生命・医学系倫理指針に記載された各手続に則って、インフォームド・コンセントを受けなければならない。ただし、法令の規定により既存試料・情報を提供する場合又は既存資料・情報の提供を受ける場合については、この限りでない。
2 インフォームド・コンセントの方法は、研究のデザインごとに別に定める。ただし、倫理審査委員会の意見を受けて学長が許可した事項については、この限りでない。
(インフォームド・アセント)
第23条の2 インフォームド・コンセントを与える能力を欠くと客観的に判断される者を研究対象者とする場合、代諾者のインフォームド・コンセントに加えて、研究対象者本人にも理解力に応じたわかりやすい説明を行い、研究についての賛意(インフォームド・アセント)を得るよう努めなければならない。
3 研究責任者は、介入を行わない生命・医学系研究で、人体から取得された試料を用いない研究を実施する場合において、生命・医学系倫理指針の規定により当該研究の情報を研究対象者等に通知し、又は公開する必要があるときは、研究対象者への通知(又は情報公開)文書(様式第9―2号)により研究対象者等に通知又は公開を行うものとする。
(同意の撤回等)
第25条 研究者等は、研究対象者等から、生命・医学系倫理指針に基づく同意の撤回又は拒否があった場合には、同意撤回書(様式第11号)により当該研究対象者等の意思を確認の上、遅滞なく、当該撤回又は拒否の内容に従った措置を講じるとともに、その旨を当該研究対象者等に説明しなければならない。ただし、当該措置を講じることが困難な場合であって、当該措置を講じないことについて倫理審査委員会の意見を聴いた上で学長が許可したときは、この限りでない。
(新たな安全性に関する情報の入手)
第26条 研究責任者は、研究対象者の安全又は当該研究の実施に悪影響を及ぼす可能性のある安全性に関する重大な情報を新たに入手したときは、当該学部長等と学長の両方に対して、速やかに口頭で報告しなければならない。更に、安全性情報等に関する報告書(様式第12号)を、学長に提出するものとする。
2 学長は、前項に規定する報告を受けたときは、安全性情報等に関する報告書を倫理審査委員会に提出し、当該研究の継続の適否等について諮問するものとする。
3 学長は、倫理審査委員会の答申に基づき、当該研究の継続の適否等について決定し、研究審査結果通知書(様式第4号)にて当該研究責任者に通知するものとする。
第6章 個人情報等
(個人情報等に係る基本的責務及び安全管理)
第27条 学長、倫理審査委員会委員、研究責任者、研究者等その他の関係者は、任務遂行上知り得た個人情報、特定の個人を識別することができる死者の情報、研究対象者の個人情報に限らず、研究の実施に伴って取得される個人情報等について、生命・医学系倫理指針に則り、適正に取り扱わなければならない。また、その職を辞した後も同様とする。
(個人情報の開示)
第28条 学長は、本人又はその代理人から、保有する個人情報のうちその本人を識別することができるものについて、開示(保有する個人情報にその本人が識別されるものが存在しない場合に、その旨を通知することを含む。以下同じ。)を求められた場合には、請求者に対し、遅滞なく、該当する個人情報を開示しなければならない。ただし、開示することにより次の各号に掲げるいずれかに該当する場合には、その全部又は一部を開示しないことができる。また、法令の規定により、保有する個人情報の開示について定めがある場合には、当該法令の規定によるものとする。
(1) 研究対象者等又は第三者の生命、身体、財産その他の権利利益を害するおそれがある場合
(2) 研究業務の適正な実施に著しい支障を及ぼすおそれがある場合
(3) 法令に違反することとなる場合
(試料、情報等の保管及び廃棄)
第29条 研究者等は、生命・医学系研究に用いられる情報及び当該情報に係る資料(以下「情報等」という。)を正確なものにしなければならない。
2 研究責任者は、人体から取得された試料及び情報等を保管するときは、研究に係る試料及び情報等の保管に関する手順書に基づき、研究計画書にその方法を記載するとともに、研究者等が情報等を正確なものにするよう指導・管理し、人体から取得された試料及び情報等の漏えい、混交、盗難、紛失等が起こらないよう必要な管理を行わなければならない。
3 研究責任者は、試料及び情報等について、可能な限り長期間保管されるよう努めなければならず、侵襲(軽微な侵襲を除く。)を伴う研究であって介入を行うものを実施する場合には、少なくとも、当該研究の終了について報告された日から5年を経過した日又は当該研究の結果の最終の公表について報告された日から3年を経過した日のいずれか遅い日までの期間、適切に保管しなければならない。また、匿名化された情報について、本学が対応表を保有する場合には、対応表の保管についても同様とする。
4 研究責任者は、人体から取得された試料及び情報等を廃棄する場合には、匿名化しなければならない。
第7章 重篤な有害事象への対応
(重篤な有害事象及び不具合等の報告)
第30条 研究責任者は、侵襲を伴う研究の実施中に研究対象者等に重篤な有害事象及び不具合等を認めたときは、直ちに適切な措置を講ずるとともに、当該学部長等と学長の両方に対して、速やかに口頭で報告しなければならない。更に、重篤な有害事象及び不具合等に関する報告書(様式第13号)を、学長に提出するものとする。
2 研究責任者は、多機関共同研究で実施する侵襲を伴う研究の実施において重篤な有害事象の発生を知った場合には、速やかに当該研究を実施する共同研究機関の研究責任者に対して、当該有害事象の発生に係る情報を共有しなければならない。
3 学長は、あらかじめ、重篤な有害事象が発生した際に研究者等が実施すべき事項に関する手順書を作成し、当該手順書に従って適正かつ円滑に対応が行われるよう必要な措置を講じなければならない。
4 学長は、第1項に規定する報告を受けたときは、重篤な有害事象及び不具合等に関する報告書を倫理審査委員会に提出し、研究の継続の適否等について諮問するものとする。
5 学長は、倫理審査委員会の答申に基づき、当該研究の継続の適否等について決定し、研究審査結果通知書(様式第4号)にて当該研究責任者に通知するものとする。
6 研究責任者は、倫理審査委員会の答申に基づき必要な措置を講じなければならない。
7 研究責任者は、侵襲(軽微な侵襲を除く。)を伴う研究であって介入を行うものの実施において予測できない重篤な有害事象が発生し、当該研究との直接の因果関係が否定できない場合には、学長に報告した上で、速やかに、厚生労働大臣に報告し、対応の状況及び結果を公表しなければならない。
第8章 研究の信頼性確保
(モニタリング及び監査)
第31条 研究責任者は、研究の信頼性の確保に努めなければならず、侵襲(軽微な侵襲を除く。)を伴う生命・医学系研究であって介入を行うものを実施する場合には、学長の許可を受けた研究計画書に定めるところにより、モニタリング及び必要に応じて監査を実施しなければならない。
(利益相反の管理)
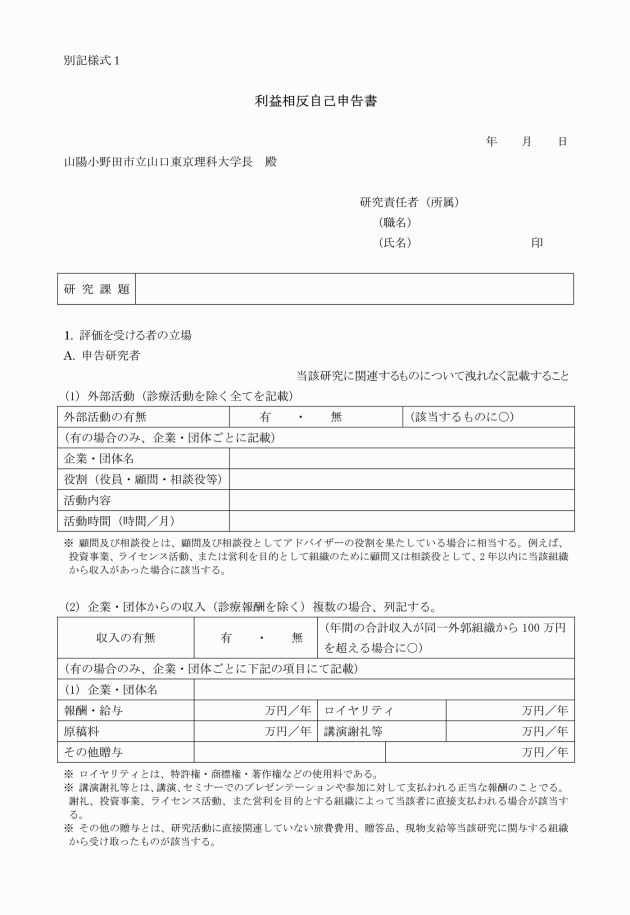
第32条 研究者等は、生命・医学系研究を実施するときは、個人の収益等、当該研究に係る利益相反に関する状況について、その状況を研究責任者に報告し、透明性を確保するよう適切に対応しなければならない。
2 研究責任者は、医薬品又は医療機器の有効性又は安全性に関する研究等、商業活動に関連し得る研究を実施する場合には、当該研究に係る利益相反に関する状況を把握し、研究計画書に記載しなければならない。
第9章 その他
(規程の運用)
第33条 この規程の運用については、この規程に定めるもののほか、生命・医学系倫理指針、関係法令等に定める基準による。
(事務)
第34条 倫理審査委員会に関する事務は、施設管理課において処理するものとする。
(雑則)
第35条 この規程に定めるもののほか、この規程の実施に関し必要な事項は、別に定める。
附則
この規程は、平成30年10月1日から施行する。
附則(平成31年4月1日規程第79号)
この規程は、平成31年4月1日から施行する。
附則(令和2年1月1日規程第1号)
この規程は、令和2年1月1日から施行する。
附則(令和2年4月1日規程第81号)
この規程は、令和2年4月1日から施行する。
附則(令和3年4月1日規程第51号)
この規程は、令和3年4月1日から施行する。
附則(令和3年12月1日規程第69号)
1 この規程は、令和3年12月1日から施行する。
2 山陽小野田市立山口東京理科大学ヒトゲノム・遺伝子解析研究に関する規則(平成30年規則第2号)は廃止する。
3 この規程の施行の際、現にヒトゲノム・遺伝子解析研究に関する倫理指針(平成13年3月29日文部科学省・厚生労働省・経済産業省)又は人を対象とする医学系研究に関する倫理指針(平成26年12月22日文部科学省・厚生労働省)の規定により実施中の研究については、なお従前の例による。
附則(令和5年12月1日規程第40号)
この規程は、令和5年12月1日から施行する。